
BAC S Juin 2003 (Guadeloupe, Guyane, Martinique)
Enseignement obligatoire
Pile nickel/zinc
1. Réalisation de la pile :
1.1. L'électrode de nickel plonge dans la solution contenant les ions Ni2+ et d'après l'énoncé l'électrode de nickel est l'électrode positive.

1.2.1. Demi-équation de la réaction se produisant
à la cathode (+) : Ni2+(aq) + 2 e- = Ni(s)
Demi-équation de la réaction se produisant à l'anode (-) : Zn(s) = Zn2+(aq) + 2 e-
1.2.2. Au niveau de la cathode, les ions Ni2+
subissent une réduction.
Au
niveau de l'anode le zinc subit une oxydation.
1.2.3. On additionne les deux demi-équation et on obtient l'équation de la réaction suivante :
Ni2+(aq) + Zn(s) = Ni(s) + Zn2+(aq)
1.2.4. Calcul de Qr,i : Qr,i
= ([Zn2+(aq)]i * [Ni(s)]i) / ([Ni2+(aq)]i
* [Zn(s)]i)
or [Zn(s)]i = 1 et [Ni(s)]i = 1 car
lorsque des espèces solides interviennent dans la réaction, elles sont
représentées par le nombre 1 dans le quotient de réaction.
On a donc :
Qr,i = [Zn2+(aq)]i / [Ni2+(aq)]i
Qr,i = 5,0.10-2 / 5,0.10-2
Qr,i = 1,0
Comme Qr,i est très inférieur à la constante d'équilibre K, la réaction a lieu dans le sens direct. On a donc bien une consommation d'électrons à la cathode (+).
2. Etude de la pile :
2.1.

2.2. Les ions Ni2+ sont consommés donc
leur concentration diminue.
Les ions Zn2+
sont produits donc leur concentration augmente.
Comme Qr = [Zn2+(aq)] /
[Ni2+(aq)] le quotient de réaction augmente.
2.3. La pile s'arrêtera de débiter lorsque le
système aura atteint l'état d'équilibre c'est-à-dire lorsque Qr
sera égale à K.
A l'équilibre : Qr,eq
= K = 1018
2.4.
| équation de la réaction | Ni2+(aq) + Zn(s) = Ni(s) + Zn2+(aq) | ||||
| état du système | avancement en mol |
quantités de matière en mol |
|||
| initial | 0 | n(Ni2+)i | n(Zn)i | n(Ni)i | n(Zn2+)i |
| intermédiaire | x | n(Ni2+)i - x | n(Zn)i -x | n(Ni)i + x | n(Zn2+)i + x |
| final | xmax | n(Ni2+)i - xmax | n(Zn)i -xmax | n(Ni)i + xmax | n(Zn2+)i + xmax |
Or n(Ni2+)i = C * V
n(Ni2+)i = 5,0.10-2 * 100.10-3
n(Ni2+)i = 5,0.10-3 mol
Si la réaction est totale et que la masse des
électrodes ne limite pas la réaction, le réactif limitant est les ions Ni2+.
On a donc n(Ni2+)f = 0.
n(Ni2+)i
- xmax = 0
xmax = 5,0.10-3 mol
L'avancement maximal de la réaction est de 5,0.10-3 mole.
2.5.1.
| demi-équation de réaction | Ni2+(aq) + 2 e- = Ni(s) | |||
| état du système | avancement en mol | quantités de matière en mol | ||
| initial | 0 | 5,0.10-3 | n(e-) | n(Ni)i |
| intermédiaire | x | 5,0.10-3 - x | n(e-) - 2 x | n(Ni)i + x |
| final | xmax = 5,0.10-3 | 0 | n(e-) - 2 xmax = 0 | n(Ni)i + 5,0.10-3 |
n(e-) - 2 xmax = 0
n(e-) = 2 xmax
2.5.2. Soit Q la quantité totale d'électricité fournie et F la
charge d'une mole d'électrons, on a :
Q = n(e-) * F
Q = 2 * xmax * F
Q = 2 * 5,0.10-3 * 96500
Q = 9,7.102 C
3. Décharge partielle d'une pile :
3.1.1.
|
demi-équation de réaction |
Ni2+(aq) + 2 e- = Ni(s) | |||
| état du système | avancement en mol | quantités de matière en mol | ||
| initial | 0 | 5,0.10-3 | n(e-) | n(Ni)i |
| intermédiaire | x | 5,0.10-3 - x | n(e-) - 2 x | n(Ni)i + x |
| final | xmax | 0 | n(e-) - 2 xmax = 0 | n(Ni)i + xmax |
Au bout d'une heure de fonctionnement on suppose que l'état final n'a pas encore été atteint. La quantité de matière de Ni2+ consommé notée ndisp(Ni2+) correspond à l'avancement de la réaction x et la quantité de matière de Ni formée notée nformée(Ni) correspond également à l'avancement x d'après la deuxième ligne du tableau d'avancement.
ndisp(Ni2+) = nformée(Ni)
Or nformée(Ni) = Δm / M(Ni)
On a donc : ndisp(Ni2+) = 100.10-3 / 58,7
ndisp(Ni2+) = 1,70.10-3 mol
3.1.2. Nous avons vu dans la question 2.5.2. que Q = n(e-) * F
Q = 2 * x * F
Or nous savons d'après la question précédente que x = ndisp(Ni2+)
On a donc : Q = 2 * ndisp(Ni2+) * F
Q = 2 * 1,70.10-3 * 96500
Q = 329 C
3.1.3. Q = I * Δt
I = Q /
Δt
I = 329
/ 3600
I =
91,4 mA
3.2.
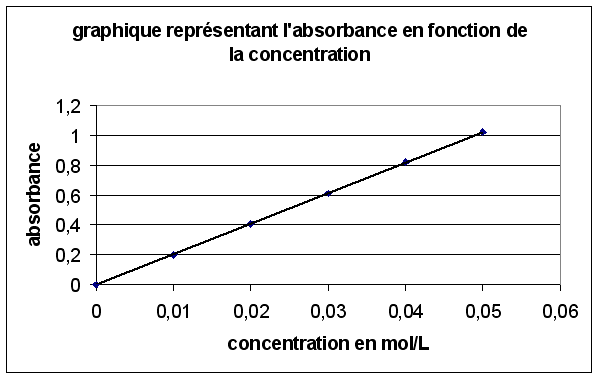
3.3.1. Graphiquement pour une absorbance de 0,67 on trouve une concentration C' de 0,033 mol.L-1.
3.3.2. C' = (n(Ni2+)i - ndisp(Ni2+))
/ V
ndisp(Ni2+)
= n(Ni2+)i - (C' * V)
ndisp(Ni2+)
= 5,0.10-2 - (3,3.10-2 * 100.10-3)
ndisp(Ni2+)
= 1,7.10-3 mol
Le
résultat est identique à celui trouvé dans la question 3.1.1.
Aller à la page d'accueil du site SciencesPhy
© Olivier STOCK