
BAC S Juin 2004 (Liban)
Enseignement obligatoire
Chimie et spéléologie
Nous utiliserons les notations suivantes dans la rédaction de
l'exercice :
n désigne une quantité de matière
m désigne une masse
M désigne une masse molaire
Les concentrations des espèces en solution sont notés entre crochets []
1. La densité du dioxyde de carbone par rapport à l'air
est : d = M(CO2) / 29
Or M(CO2) = M(C) + 2 * M(O)
d = (12 + 2 * 16) / 29
d = 1,5
La densité du dioxyde de carbone est supérieure à la densité de l'air qui est égale à 1. Le dioxyde de carbone se trouvera donc dans les endroits de la grotte indiqués sur le schéma ci-dessous.

2. Détermination de la quantité de matière de carbonate de
calcium :
n(CaCO3) = m(CaCO3) / M(CaCO3)
n(CaCO3) = m(CaCO3) / (M(Ca) + M(C) + 3 * M(O))
n(CaCO3) = 2,0 / (40 + 12 + 3 * 16)
n(CaCO3) = 2,0.10-2 mol
Détermination de la quantité de matière des ions oxonium :
n(H3O+) = [H3O+] * Vs
n(H3O+) = 0,10 * 100.10-3
n(H3O+) = 1,0.10-2 mol
On a donc mélanger 2,0.10-2 mol de carbonate de calcium avec 1,0.10-2 mol d'ions oxonium.
3. D'après les nombres stoechiométriques 1 mol de carbonate de calcium
réagit avec 2 mol d'ions oxonium. On a donc 5,0.10-3 mol de
carbonate de calcium qui réagit avec 1,0.10-2 mol d'ions oxonium.
Tous les ions oxonium seront donc consommés et le réactif limitant est le
carbonate de calcium.
Remarque : on peut également calculer l'avancement maximal dans le cas où le réactif limitant serait le carbonate de calcium puis dans le cas où le réactif limitant serait les ions oxonium. L'avancement
maximal est celui qui a la plus petite valeur.
| Equation chimique | CaCO3(s) + 2 H3O+(aq) = Ca2+(aq) + CO2(g) + 3 H2O(l) | |||||
| Etat du système | Avancement en mol |
Quantités de matière en mol |
||||
| initial | 0 | 2,0.10-2 | 1,0.10-2 | 0 | 0 |
solvant |
| intermédiaire | x | 2,0.10-2-x | 1,0.10-2-2x | x | x | |
| final | xmax | 2,0.10-2-xmax | 1,0.10-2-2xmax=0 | xmax | xmax | |
1,0.10-2-2xmax = 0
2xmax = 1,0.10-2
xmax = 1,0.10-2 / 2
xmax = 5,0.10-3 mol
4.a. D'après le tableau d'avancement x = n(CO2)
Or d'après l'équation d'état des gaz parfait : P V(CO2) = n(CO2) R T
d'où n(CO2) = P V(CO2) / R T
On a donc x = P V(CO2) / R T
Application numérique à t = 20 s
x(t=20s) = 1,02.105 * 29.10-6 / (8,31 * 298)
x(t=20s) = 1,2.10-3 mol
b. n(CO2)max = xmax
P V(CO2)max = n(CO2)max R T
V(CO2)max = xmax R T / P
V(CO2)max = 5,0.10-3 * 8,31 * 298 / 1,02.105
V(CO2)max = 1,21.10-4 m3
V(CO2)max =121 mL
Le volume de dioxyde de carbone en fin d'expérience correspondant au volume maximal de dioxyde de carbone dégagé, on peut en conclure que la transformation est totale.
5.a. Soit v(t) la vitesse volumique de réaction :
v(t) = (1 / Vs)
* (dx / dt)
Au cours du temps la vitesse diminue car la variation de l'avancement diminue au cours du temps.
b. Le temps de demi-réaction est le temps au bout duquel l'avancement a atteint la moitié de sa valeur maximal. Ici t1/2 = 57 s
6.a. La vitesse volumique de réaction dépend de la température. Plus la température diminue, plus la vitesse volumique de réaction diminue. Ceci est valable quelque soit la date.
b. 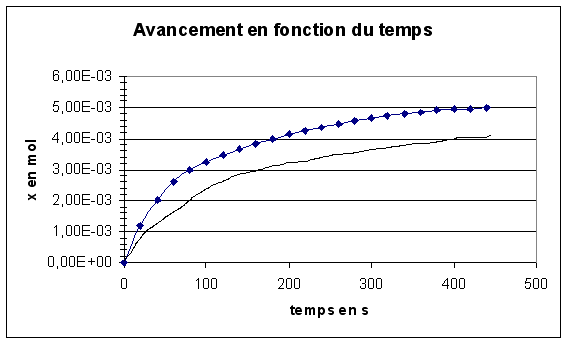
7.a. Les ions présents sont : les ions oxonium H3O+, les ions chlorure Cl- et les ions calcium Ca2+. Les ions chlorure sont des ions spectateurs (ils n'interviennent pas dans l'équation de la réaction chimique).
b. La concentration des ions chlorure ne varie pas. A chaque fois que deux ions oxonium sont consommés, un seul ion calcium est produit. Le nombre d'ions présents dans la solution diminue et la conductivité ionique molaire de l'ion consommé est bien plus grande que la conductivité molaire de l'ion produit. Il est donc normale d'observer une diminution de la conductivité de la solution.
c. σ0 = λ(H3O+)
* [H3O+]0 + &lambda(Cl-) * [Cl-]0
[H3O+]0 = [Cl-]0 = 0,10 mol.L-1
σ0 = 35,0.10-3 *
0,10.103 + 7,5.10-3 * 0,10.103
σ0 = 4,25 S.m-1
d. σ = λ(H3O+)
* [H3O+] + λ(Cl-) * [Cl-] + λ(Ca2+) *
[Ca2+]
σ = 35,0.10-3 * (1,0.10-2
- 2x) / 100.106 + 7,5.10-3 * 0,10.103 + 12,0.10-3
* x / 100.106
σ = σ0 - x (2 *
35,0.10-3 - 12,0.10-3) / 100.10-6
σ = σ0 - 580 x
σ = 4,25 - 580 x
e. σ = 4,25 - 580 xmax
σ = 4,25 - 580 * 5,0.10-3
σ = 1,35 S.m-1
Aller à la page d'accueil du site SciencesPhy
© Olivier STOCK