BAC S Septembre 2005 (Métropole)
Enseignement obligatoire
Calculatrice interdite
A propos du marquage isotopique
Le marquage isotopique consiste à remplacer dans la molécule que l’on désire étudier, un atome ou un groupe d’atomes par un atome radioactif de manière à pouvoir l’utiliser comme traceur.
Dans cet exercice on s’intéressera à deux applications de cette technique :
- en physique avec une technique d’imagerie médicale
- en chimie avec l’étude d’une réaction.
Les parties 1 et 2 sont indépendantes
1. Marquage isotopique et technique d’imagerie médicale
En cancérologie, le traceur utilisé pour l’imagerie médicale est le glucose marqué par le fluor 18. Ce traceur s’accumule préférentiellement dans les cellules cancéreuses, grandes consommatrices de sucre. Cette technique se singularise par l’utilisation d’isotopes radioactifs dont le temps de demi-vie est beaucoup plus court que les produits classiques de la médecine nucléaire. Ainsi le fluor 18 a un temps de demi-vie radioactive de 110 minutes. Pour cette raison le traceur est fabriqué sur place de manière à ce qu’au moment de son injection au patient la dose administrée ait une activité de 260 MBq.
1.1. Désintégration du « fluor 18 »
Le « fluor 18 » ( ![]() ) est un isotope radioactif du fluor. Il est produit sur place dans le laboratoire d’imagerie médicale. Le « fluor 18 » se désintègre spontanément pour donner l’isotope 18 de l’oxygène (
) est un isotope radioactif du fluor. Il est produit sur place dans le laboratoire d’imagerie médicale. Le « fluor 18 » se désintègre spontanément pour donner l’isotope 18 de l’oxygène (
![]() ). L’équation de cette réaction nucléaire peut s’écrire :
). L’équation de cette réaction nucléaire peut s’écrire :
![]()
1.1.1. Donner la composition du noyau de l’isotope 18 du fluor.
1.1.2. En appliquant les lois de conservation déterminer Z et A. Cette désintégration est-elle du type α, β- ou β+ ?
1.2. Constante radioactive du « fluor 18 »
Le laboratoire d’imagerie médicale est équipé d’un appareil qui permet de remplacer un groupement hydroxyle –OH du glucose par un atome de « fluor 18 ». Le nombre N de noyaux radioactifs de « fluor 18 » encore présents varie en fonction du temps et suit une loi de décroissance exponentielle : N = N0.e-λt. La relation liant la constante radioactive et le temps de demi-vie est : t1/2 = ln 2 / λ
1.2.1. Donner la définition du temps de demi-vie radioactive.
1.2.2. Par une analyse dimensionnelle, déterminer l’unité de l dans le système international. À l’aide des données du texte encadré, choisir parmi les nombres suivants, celui qui permet d’évaluer l’ordre de grandeur de λ.
10-4 10-3 10-2
Aide au calcul : ln 2 = 6,9.10-1
1.3. Activité du « fluor 18 »
L’équipe du laboratoire d’imagerie médicale doit réaliser 2 examens dans la matinée sur deux patients différents. Deux doses de traceur contenant le même nombre N0 de noyaux radioactifs sont fabriquées en même temps avant leur injection pour réaliser ces examens. Au moment de son injection au patient la dose de traceur doit avoir une activité de 260 MBq. Lors du premier examen on injectera la dose notée
D1 à 9 h 00. On rappelle que l’activité A du « fluor 18 » présent dans le traceur est reliée à la variation ΔN du nombre de noyaux radioactifs de cet isotope pendant une durée Δt par la relation :
A = -ΔN / Δt . (Si Δt est suffisamment petit, on peut écrire A = - dN / dt )
La mesure expérimentale de l’activité de chaque dose, toutes les vingt minutes, à partir de la date
t = 0 min (instant de fabrication), a permis de tracer le graphe A = f(t) représentés sur la figure
1.
On rappelle que : 1MBq = 106 Bq
1.3.1. Après avoir rappelé l’expression du nombre de noyaux radioactifs noté N encore présents à l’instant de date t, montrer que l’activité A de la source radioactive peut se mettre sous la forme : A = A0.e-λt. Exprimer littéralement A0 en fonction de λ et N0.
1.3.2. Calculer le nombre de noyaux de « fluor 18 » présents dans la dose de traceur au moment de son injection au patient lors d’un examen médical. On donne λ = 1.10-4 s-1
1.3.3. En s’aidant de la Figure 1 de l'annexe, déterminer l’heure de la fabrication de la dose de traceur notée D1. A quelle heure le deuxième examen correspondant à l’injection de la dose notée D2 préparée en même temps que la dose D1 aura-t-il lieu ?
1.3.4. L’injection d’une dose a lieu à l’instant de date ti. Calculer l’ordre de grandeur, exprimé en heures, du temps nécessaire après l’injection pour que l’activité soit 100 fois plus faible qu’au moment de l’injection.
Aide au calcul : ln 100 = 4,6 4,6 / 3,6 = 1,3
1.4. Méthode d’Euler
Il est souvent utile de prévoir les courbes de décroissance par une méthode de calcul, la méthode d’Euler par exemple, sans procéder à l’expérience.
À partir de la loi de décroissance A = A0.e-λt, l’équation différentielle vérifiée par l’activité A du traceur est : .
dA
/ dt + λ A = 0
La méthode d’Euler consiste à introduire les notations suivantes :
dA / dt= ΔA / Δt pour des intervalles de temps Δt très petits
A(tn+1) = A (tn) + ΔA(tn) avec tn+1 =
tn + Δt et où Δt est appelé « pas de résolution ».
1.4.1. Montrer que la relation de récurrence entre A(tn+1) et A(tn) peut se mettre sous la forme : A(tn+1) = (1 – λ Δt).A(tn).
1.4.2. À l’aide de la relation précédente, calculer en MBq la valeur de l’activité A(t1) à l’instant de date t1 = 100 s et la valeur de l’activité A(t2) à l’instant de date t2 = 200 s et vérifier sur la courbe de la figure 2, la validité de ces résultats.
On prendra A0 = 800 MBq, Δt = 100 s et &lambda = 1.10-4 s-1.
1.4.3. La validité de la méthode d’Euler est liée au choix du pas de résolution. Quels sont l’intérêt et l’inconvénient du choix d’un pas de résolution Δt = 1 s dans cet exemple ?

figure 2 : Agrandissement de la courbe A = f(t) (Dose D2) de la
figure 1 de l'annexe
pour les vingt premières minutes
2. Utilisation du marquage isotopique en chimie
Le salicylate de méthyle est le composant principal d’une huile essentielle naturelle appelée essence de wintergreen extraite par hydrodistillation des feuilles de gaulthérie, bruyère d’Amérique du Nord et de Chine. Doté d’une odeur caractéristique, il confère à cette huile essentielle des propriétés analgésique et anti-inflammatoire puissantes. Appliqué par voie cutanée sous forme de pommade, il est très apprécié des sportifs tant avant qu’après l’effort. Pour des raisons économiques le salicylate de méthyle est à l’heure actuelle synthétisé à partir de l’acide salicylique et du méthanol.
2.1. Synthèse du salicylate de méthyle au laboratoire Dans un ballon on introduit 69 g d’acide salicylique, 32 g de méthanol, 1mL d’acide sulfurique et quelques grains de pierre ponce. On adapte le ballon au dispositif expérimental (montage à reflux) schématisé par la Figure 3 ci-dessous et on chauffe le milieu réactionnel pendant deux heures sous hotte.
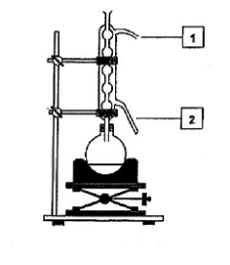
figure 3
Données : masses molaires moléculaires -
acide salicylique : M1 = 138 g.mol-1
- méthanol : M2 = 32 g.mol-1
formule semi-développée de l'acide salicylique 
2.1.1. Écrire l’équation de la réaction modélisant la synthèse du salicylate de méthyle.
2.1.2. Nommer cette réaction et donner ses caractéristiques.
2.1.3. Préciser le rôle joué par l’acide sulfurique lors de cette réaction.
2.1.4. Indiquer la fonction des tubes 1 et 2 de la Figure 3 en précisant le sens de circulation du fluide. Quel est l’intérêt de ce montage ?
2.1.5. Quel est le réactif limitant ? Pourquoi n’a-t-on pas introduit les réactifs dans les proportions stœchiométriques ?
2.2. Première approche de la compréhension du mécanisme de la transformation grâce au marquage isotopique.
Le mécanisme de la réaction précédente n’est pas simple. Cependant la méthode expérimentale du marquage isotopique permet de comprendre quelles liaisons sont rompues. Une rupture est représentée ci-dessous d’une manière schématique par des pointillés. On effectue la réaction avec un alcool, préparé spécialement, dans lequel l’oxygène est l’isotope 18O noté O* (au lieu de l’isotope le plus abondant 16O). On constate expérimentalement que cet oxygène « lourd » se retrouve au niveau des produits dans le salicylate de méthyle uniquement et que l’eau formée ne contient pas plus d’isotope 18O que l’eau naturelle. On envisage les deux hypothèses suivantes :
| acide carboxylique | alcool | |
| hypothèse 1 |  |
|
| hypothèse 2 |  |
Choisir l'hypothèse en accord avec les observations expérimentales. Justifier la réponse (l'équation de la réaction n'est pas exigée).
Annexe :
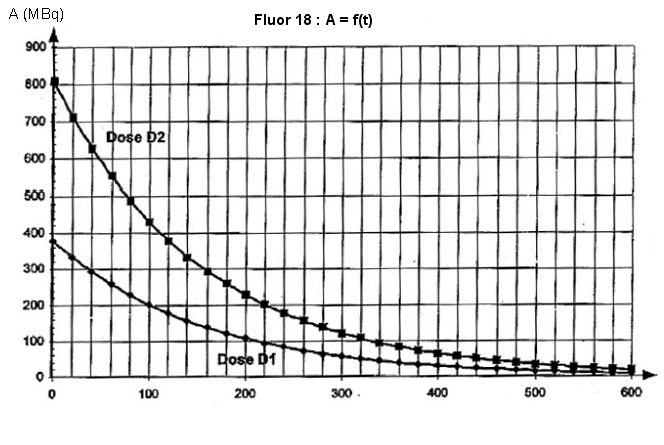
figure1
Aller à la page d'accueil du site SciencesPhy
© Olivier STOCK