
Détermination de constantes d'acidité
par la méthode de Bjerum
Pour certains acides, il est possible de déterminer la constante d'acidité à partir de la courbe de dosage par une lecture du graphe en sachant qu'à la demi-équivalence on a pH=pKa. Cette propriété vient de la relation pH=pKa + log [base]/[acide]. A la demi-équivalence, on a par définition [base]=[acide] d'où pH=pKa à la demi-équivalence. Mais cette technique ne peut pas être utilisée dans tous les cas car la relation pH=pKa + log [base]/[acide] est obtenue en effectuant des approximations et pour les diacides le problème est souvent plus compliqué.
Pour déterminer les constantes d'acidité, sans utiliser de relations obtenues après avoir fait des approximations, on peut utiliser la technique mise au point par Bjerum.
Dans une première partie la technique va être détaillée dans le cas d'un diacide, puis dans une deuxième partie nous allons l'appliquer pour déterminer les constantes d'acidité de l'acide fumarique et de l'acide maléique.
Remarque : dans tout l'exposé de cette méthode nous considèrerons que nous pouvons assimiler les concentrations des espèces à leur activité.
I. Principe de la détermination des constantes d'acidité d'un diacide :
On étudie un diacide noté H2A. Ce diacide se dissocie dans l'eau suivants les réactions chimiques (1) et (2) :
H2A + H2O = HA- + H3O+ (1)
HA- + H2O = A2- + H3O+ (2)
L'équation (1) est caractérisée par une constante d'équilibre notée Ka1 avec Ka1 = [H3O+]*[HA-]/[H2A]
L'équation (2) est caractérisée par une constante d'équilibre notée Ka2 avec Ka2 = [H3O+]*[A2-]/[HA-]
On réalise le dosage du diacide par une solution d'hydroxyde de sodium (attention il faut noter le volume d'eau ajouté éventuellement à la solution à doser pour permettre aux électrodes de tremper correctement dans la solution) et à partir du dosage on détermine le nombre moyen de protons fixés par entité A2- (on note ce nombre n).
n = ([HA-] + 2[H2A]) / ([H2A] + [HA-] + [A2-])
Une fois la valeur de n déterminée, on trace la courbe représentant l'évolution du nombre moyen de protons fixés par entité A2- en fonction du pH (n=f(pH)) et on réalise une modélisation pour déterminer les constantes d'acidité.
1. Calcul de n :
Pour calculer n, on écrit les équations d'électroneutralité et de conservation de la matière.
D'après la conservation de la matière, on a : [H2A] + [HA-] + [A2-] = (cA * VA) / (VA + VB)
D'où [A2-] = (cA * VA) / (VA + VB) - [H2A] - [HA-]
D'après l'électroneutralité, on a : [HA-] + 2[A2-] + [HO-] = [H3O+] + [Na+]
avec [Na+] = (cB * VB) / (VA + VB)
D'où [HA-] + 2 ((cA * VA) / (VA + VB) - [H2A] - [HA-]) + [HO-] = [H3O+] + (cB * VB) / (VA + VB)
On a donc 2[H2A] + [HA-] = (cA * VA) / (VA + VB) + [HO-] - [H3O+] -(cB * VB) / (VA + VB)
Nous avons vu d'après la définition de n que : n = ([HA-] + 2[H2A]) / ([H2A] + [HA-] + [A2-])
On a donc n = 2 - (((cB * VB) / (VA + VB) - [HO-] + [H3O+]) / ((cA * VA) / (VA + VB)))
Or [HO-] = Ke / [H3O+]
D'où n = 2 - (((cB * VB) / (VA + VB) - (Ke / [H3O+]) + [H3O+]) / ((cA * VA) / (VA + VB)))
Remarques :
[H3O+] = 10-pH
Pour déterminer n, il faut connaître la constante de dissociation de l'eau qui dépend de la température. Cette constante peut être déterminée en modélisant la dernière partie de la courbe de dosage par : pH = pKe + log (cB (VB - VBeq)) / (VA + VB)
2. Equation de modélisation :
Pour la modélisation, on cherche à exprimer n en fonction de [H3O+], Ka1 et Ka2.
Nous avons vu d'après la définition de n que : n = ([HA-] + 2[H2A]) / ([H2A] + [HA-] + [A2-])
Or [HA-] = Ka1 * [H2A] / [H3O+]
Et [A2-] = Ka2 * [HA-] / [H3O+] = Ka1 * Ka2 * [H2A] / [H3O+]2
On a donc n = ([H2A] * (2 + Ka1 / [H3O+])) / ([H2A] * (1 + Ka1 / [H3O+] + Ka1 * Ka2 / [H3O+]2))
L'équation de modélisation est donc : n = (2 * [H3O+]2 + Ka1 * [H3O+]) / ([H3O+]2 + Ka1 * [H3O+] + Ka1 * Ka2)
II. Appliquation aux acides fumarique et maléique :
Les acides fumarique et maléique sont des isomères Z-E de formule brute C4H4O4.
1. Détermination des constantes d'acidité de l'acide maléique :
On a effectué le dosage d'une solution contenant 0,187g d'acide maléique dans 50 mL d'eau par de la soude de concentration environs 0,2 mol/L.
On obtient les résultats suivants :

Graphique représentant l'évolution du pH en fonction du volume de soude ajouté :
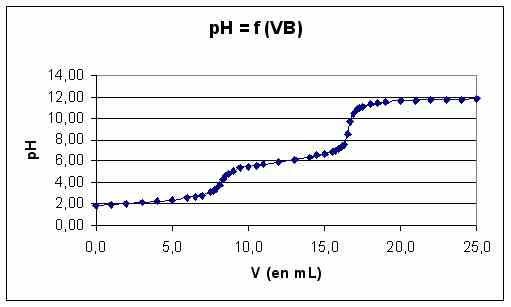
La température lors du dosage était de 21°C. La courbe de dosage permet de déterminer la concentration de l'hydroxyde de sodium : cB = 0,196 mol/L. Une modélisation de la fin de la courbe de dosage permet de déterminer la constante ionique de l'eau : Ke = 2,63.10-14. Pour calculer n, on a utilisé la formule : n = 2 - (((cB * VB) / (VA + VB) - (Ke / [H3O+]) + [H3O+]) / ((cA * VA) / (VA + VB)))
On trace le graphique représentant l'évolution de n en fonction du pH et on effectue une modélisation de la forme : n = (2 * [H3O+]2 + Ka1 * [H3O+]) / ([H3O+]2 + Ka1 * [H3O+] + Ka1 * Ka2)

La modélisation donne les résultats suivants :
Ka1 = (12,64±0,41).10-3
Ka2 = (929±23).10-9
On en déduit les valeurs des pKa de l'acide maléique à 21°C :
pKa1 = 1,90
pKa2 = 6,03
2. Détermination des constantes d'acidité de l'acide fumarique :
On a effectué le dosage d'une solution contenant 0,187g d'acide fumarique dans 150 mL d'eau par de la soude de concentration environs 0,2 mol/L.
On obtient les résultats suivants :

Graphique représentant l'évolution du pH en fonction du volume de soude ajouté :

La température lors du dosage était de 21°C. La courbe de dosage permet de déterminer la concentration de l'hydroxyde de sodium : cB = 0,200 mol/L. Une modélisation de la fin de la courbe de dosage permet de déterminer la constante ionique de l'eau : Ke = 1,82.10-14. Pour calculer n, on a utilisé la formule : n = 2 - (((cB * VB) / (VA + VB) - (Ke / [H3O+]) + [H3O+]) / ((cA * VA) / (VA + VB)))
On trace le graphique représentant l'évolution de n en fonction du pH et on effectue une modélisation de la forme : n = (2 * [H3O+]2 + Ka1 * [H3O+]) / ([H3O+]2 + Ka1 * [H3O+] + Ka1 * Ka2)
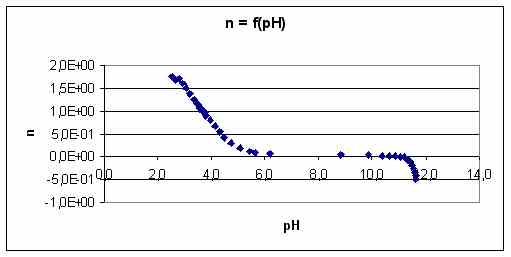
La modélisation donne les résultats suivants :
Ka1 = 1,01.10-3
Ka2 = 5,52.10-5
On en déduit les valeurs des pKa de l'acide maléique à 21°C :
pKa1 = 2,99
pKa2 = 4,25
Aller à la page d'accueil du site SciencesPhy
© Olivier STOCK